A Revolução das Diretrizes da CSA: O Que Esperar do Futuro!
A Nova Era da Garantia de Software Já Começou!
Prepare-se para entender o que a FDA está aprontando!
Você já ouviu falar nas novas diretrizes que estão bombando na área da Garantia de Software? Pois bem, a FDA, essa entidade que todos amam odiar, acaba de soltar as suas novas regras sobre a ‘Computer Software Assurance’! É isso mesmo, em setembro de 2025, a FDA divulgou um verdadeiro manifesto sobre como as empresas devem se comportar quando falamos de software de sistema computadorizado. A questão é: você está preparado para essa mudança radical que pode afetar todo o seu negócio?
As diretrizes são uma prova de como a FDA imagina um futuro iluminado e repleto de conformidade, especialmente para software de qualidade e compliance. Se você achava que a burocracia ia te engolir, pode se preparar! Agora, o jogo virou e eles estão prometendo simplificar tudo — mas será que é verdade ou apenas mais uma cortina de fumaça do governo, que adora complicar a vida do trabalhador?
Essas regras não são apenas papel, meus amigos. Elas definem a nova era do que significa ter certeza de que o software que você está usando é realmente eficaz e seguro. Prepare-se, porque vamos mergulhar fundo nos detalhes escandalosos dessas novas diretrizes da FDA!
O Que é, Afinal, a Garantia de Sistema Computadorizado?
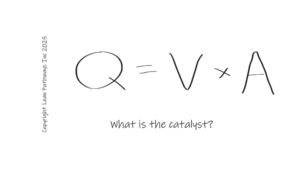
Ah, a famosa Garantia de Sistema Computadorizado! Em termos simples, a FDA está dizendo que isso é um approach super técnico que garante que o software que você tá usando é adequado para o seu propósito. Mas calma, não é só isso! Essa abordagem maluca considera todos os riscos que podem surgir, desde a segurança até a qualidade do dispositivo! Mais burocracia, alguém?
E vamos ser claros: ninguém quer todo aquele trabalho de validação chato, que consome tempo e recursos. Então, é por isso que a garantia de sistema computacional segue um caminho mais leve, onde a carga de validação só é feita quando realmente necessário. Mas será que esse “mínimo necessário” vai mesmo ajudar na qualidade do produto ou só vai aumentar os riscos? Só o tempo dirá!
Em suma, essa tal de CSA promete dar uma nova cara ao jeito como sua empresa lida com tecnologia. Chega de sufoco! Ou será que é só mais um truque do governo para nos empurrar um mar de regras desnecessárias?
O Que Aconteceu Com a Validação de Sistema Computadorizado?
Você deve estar se perguntando: e a validação de sistema, como fica? A FDA simplesmente a desativou, jogando a velha CSV no lixo da história! A razão é simples: a CSA vem para descomplicar a vida das empresas na área de ciências da vida, dando um verdadeiro golpe nas barreiras que sempre impediram a adoção de novas ferramentas digitais. Uma mudança arriscada, não acha?
Desde 1997, a CSV era vista como a vilã, cheia de tarefas longas, complexidades sem fim e uma tonelada de documentação que só fazia atrapalhar. Se ferrar com as autoridades regulatórias era a última coisa que as empresas queriam, mas o que a FDA agora promete parece um sonho… ou será uma armadilha?
A lógica é simples: cada empresa vai tratar suas necessidades de maneira direta, sem aqueles trajes de gala de ‘conformidade’ que não servem para nada. Será que eles conseguirão simplificar, ou isso vai terminar em um fiasco monumental?
O Passo a Passo da Nova CSA: Um Guia para a Sobrevivência
Prepare-se, porque a FDA já preparou um roteiro que promete guiar sua empresa nesse novo mundo. Acompanhe:
-
Identifique o uso pretendido do software: Descubra se ele é parte direta do seu sistema de produção ou se é apenas um coadjuvante. E não se esqueça: podem existir múltiplos usos!
-
Determine a abordagem baseada em riscos: Sim, é hora de avaliar os riscos, e saiba que um software de eQMS como o Qualio é muito menos arriscado do que um sistema de relatório de eventos adversos. Tá vendo como a coisa fica complicada?
-
Determine a atividade de garantia apropriada: Agora, quanto de prova objetiva você vai precisar ter? A pergunta que não quer calar: você vai testar suas soluções de forma robusta ou só vamos por aqui fazer um teste meia boca?
- Estabeleça um registro adequado: Seu registro de atividades da CSA precisa ser mais do que uma folha de papel! É preciso incluir tudo: desde o uso identificado do software até as atividades de garantia que foram realizadas. Mais burocracia, quer ver?
Tá preparado para essa aventura cheia de reviravoltas? A FDA está na área, e é bom você se manter atento para não ficar pra trás!